La phase d’élongation, la deuxième du processus de la synthèse des protéines, a besoin de protéines spécifiques qui ne sont pas des ribosomes comme les FE et les EEFs. L'élongation des polypeptides se produit cycliquement de façon qu’à la fin d’un cycle d’addition d’acides aminés, la place A sera vide et prête à accepter l'aminoacyl-tARN dicté par le codon suivant de l'mARN.
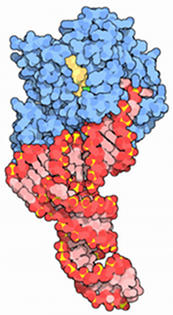
Cela veut dire que les acides aminés entrés doivent s’ajouter à la chaîne peptidique et que le ribosome doit passer l'mARN au codon suivant. Chaque aminoacyl-tARN est conduit au ribosome par un EEF-1α-GTP complexe.
Quand le tARN correcte est déposté dans la place A du GTP et hydrolysé, l'EEF-1α-GDP complexe se dissocie. Pour des événements additionnels de translocation, le GDP doit s’échanger avec le GTP. Ce processus est terminé par l'EEF-1βγ de la même façon dans laquelle se produit l’échange de GTP avec l'FEI-2 catalysé par l'EIF-2B.
Le peptide lié au tARN dans la place P se transfert dans le groupe amino dans l'aminoacyl-tARN dans la place A. Cette réaction est catalysée par les peptidyls transférase. Ce processus est appelé transpeptidation. Le peptide allongé se trouve dans le tARN dans la place A, qui doit rester libre pour accepter l'aminoacyl-tARN suivant. Le processus de bouger le peptidyl-tARN de la place A à la place P s’appelle translocation.
La translocation est catalysée par le gène EEF-2 avec l’hydrolyse du GTP. Dans le processus de translocation, le ribosome bouge le long de l'mARN de façon que le codon suivant de l'mARN se situe dans la place A. Après la translocation, le gène EEF libère le ribosome et le cycle peut recommencer.
La capacité du gène EEF-2 pour terminer la translocation est régulée par le statut de phosphorilation de l’enzyme qui s’inhibe. La phosphorilation du gène EEF-2 est catalysée par l’enzyme kinase eEF2 (EEF2K). La régulation de l’activité de l’enzyme EEF2K est normalement contrôlée par l’insuline et les flux Ca2+. Les effets provoqués par le Ca2+ sont le résultat de l’interaction de la calmoduline avec l'enzyme EEF2K. L'activation de l'enzyme EEF2K dans le muscle par le Ca2+ est importante pour réduire la consommation d’ATP dans le processus de la synthèse des protéines pendant les périodes d’entraînement qui mènera à la libération du Ca2+ emmagasiné. L'enzyme EEF2K est aussi régularisé par la phosphorilation et une des kinases qui phosphorile l’enzyme est régularisée par la protéine MTOR. En plus, la protéine kinase maitrise la régulation métabolique, l'AMP-activée protéine kinase (AMPK) se phosphorile et active l’enzyme EEF2K qui provoque l’inhibition du gène EEF-2.
- Phase précédente de la synthèse des protéines: Phase initiale de la synthèse des protéines.
- Phase suivante de la synthèse des protéines: phase finale de la synthèse des protéines.
Articles en relation avec L'élongation dans la synthèse des protéines
 |  |  |
| Début de la synthèse des protéines | Fin de la synthèse des protéines | Protéine associée au développement du cancer au sein |